Existem quatro números quânticos:
- número quântico principal;
- número quântico de momento angular ou azimutal(sécundario) ;
- número quântico magnético
- número quântico de spin
Os primeiros três números quânticos são usados para descrever orbitais atômicos e a caracterização dos elétrons que neles se encontram. O quarto número quântico, número quântico de spin é utilizado na descrição do comportamento específico de cada elétron. Assim, qualquer par de elétrons pode ter até três números quânticos iguais sendo que, neste caso, necessariamente, o quarto número quântico deverá ser diferente, ou seja, este par de elétrons estará ocupando o mesmo orbital sendo que os elétrons apresentam spins opostos.
Número quântico principal
O número quântico principal pode tomar como valor qualquer número inteiro positivo. Como o próprio nome o sugere, este número quântico é o mais importante, pois o seu valor define a massa do átomo de potássio ( e de outro átomo monoelectrónico de carga nuclear Z) por meio da equação:
onde m e e são a massa dos nêutrons e a carga do elétron, ε0 é a permissividade do vácuo, e h é a constante de Planck. Esta equação foi obtida como resultado da equação de Schrodinger e é desigual a uma das equações obtidas por Bohr, utilizando os seus postulados correctos.
Número quântico de momento angular, l
O número quântico de momento angular, ou azimutal, informa-nos sobre a forma das órbitas. Como o próprio nome indica, o valor de l define o momento angular do elétron, sendo que o aumento do seu valor implica o aumento correspondente do valor do momento angular. Deste modo, a energia cinética do elétron é associada ao movimento angular e esta dependente da energia total do elétron, pelo que é natural que os valores permitidos de l estejam associados ao número quântico principal. Para um dado valor de n, l pode ter como valores possíveis os números inteiros de 0 a .
.Número quântico magnético, ml
O número quântico magnético especifica a orientação permitida para uma nuvem eletrônica no espaço, sendo que o número de orientações permitidas está diretamente relacionado à forma da nuvem (designada pelo valor de l). Dessa forma, este número quântico pode assumir valores inteiros de -l, passando por zero, até +l.- l = 0 : corresponde ao subnível s, onde existe somente uma orientação (ml = 0).
- l = 1 : corresponde ao subnível p, onde existem três orientações permitidas, que surgem em decorrência dos três valores de ml (+1, 0, -1). Os três orbitais p são denominados px, py e pz e são orientados de acordo com os três eixos cartesianoss (x, y e z).
- l = 2 : corresponde ao subnível d onde existem cinco orientações permitidas, ou seja, cinco valores de ml (-2, -1, 0, +1, +2). São designados por dz² (orientação coincidente com o eixo z), dx²-y² (orientação coincidente com os eixos x e y, simultaneamente), dxy (orientado entre os eixos x e y), dyz (orientado entre os eixos y e z) e dxz (orientado entre os eixos x e z).
Número quântico de spin, ms
O número quântico de spin indica a orientação do elétron ao redor do seu próprio eixo. Como existem apenas dois sentidos possíveis, este número quântico assume apenas os valores -1/2 e +1/2, indicando a probabilidade do 50% do elétron estar girando em um sentido ou no outro.A tabela a seguir resume os significados de cada número quântico e os valores que eles podem assumir.
| nome | símbolo | significado do orbital | faixa de valores |
|---|---|---|---|
| número quântico principal |  | camada | 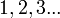 |
| número quântico azimutal |  | subnível | 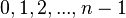 |
| número quântico magnético |  | deslocamento de energia |  |
| número quântico de spin |  | spin | 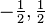 |
| n | l | Orbital | ml | ms | Número de Combinações |
|---|---|---|---|---|---|
| 1 | 0 | 1s | 0 | +1/2, -1/2 | 2 |
| 2 | 0 | 2s | 0 | +1/2, -1/2 | 2 |
| 2 | 1 | 2p | +1, 0, -1 | +1/2, -1/2 | 6 |
| 3 | 0 | 3s | 0 | +1/2, -1/2 | 2 |
| 3 | 1 | 3p | +1, 0, -1 | +1/2, -1/2 | 6 |
| 3 | 2 | 3d | +2, +1, 0, -1, -2 | +1/2, -1/2 | 10 |
| 4 | 0 | 4s | 0 | +1/2, -1/2 | 2 |
| 4 | 1 | 4p | +1, 0, -1 | +1/2, -1/2 | 6 |
| 4 | 2 | 4d | +2, +1, 0, -1, -2 | +1/2, -1/2 | 10 |
| 4 | 3 | 4f | +3, +2, +1, 0, -1, -2, -3 | +1/2, -1/2 | 14 |
Feito por: Taynah Almeida Amoêdo =)



Nenhum comentário:
Postar um comentário