Os Números quânticos se definem como códigos matemáticos associados à quantidade de energia do elétron. Através desses números podemos caracterizar um átomo.
Os números quânticos são:
- Primário (n)
- Secundário (
ℓ )
- Magnético (m)
- Spin (S)
Número quântico principal (n): se refere ao nível de energia em que os elétrons estão localizados, sendo que pode variar de 1 a 7, depende da camada em que se encontra. Essas camadas estão localizadas na eletrosfera atômica.
Para você entender melhor, usaremos a seguinte tabela:
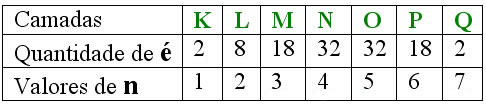 *Quantidade específica de elétrons para cada camada.
*Quantidade específica de elétrons para cada camada.
Número quântico secundário (ℓ): É referente aos subníveis (presentes nas camadas K, L, M...). Veja na tabela abaixo os valores de ℓ para cada subnível.
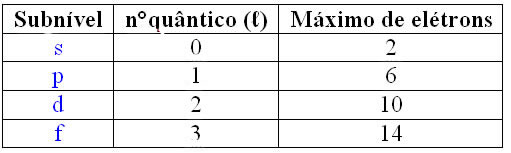 *Para cada subnível existe uma quantidade máxima de elétrons.
*Para cada subnível existe uma quantidade máxima de elétrons.
Número quântico magnético (m): Descreve a orientação do orbital no espaço. O número m pode ter qualquer valor inteiro entre +l e –l, inclusive zero.
Exemplo:
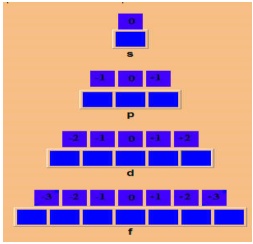
Número quântico Spin (S): Descreve a rotação do elétron em torno do seu eixo. O número ms pode ter somente os valores +1/2 e -1/2.
Dois elétrons de um mesmo orbital apresentam os três primeiros números quânticos iguais, mas possuem spins opostos. Portanto, de acordo com Pauli, dois elétrons de um mesmo átomo nunca podem ter os mesmos quatro números quânticos.
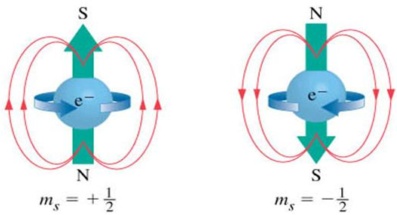
*O primeiro elétron que entra em um orbital pode ter Spin -1/2 ou +1/2.
Meu nome é: "Diogo Marinho"
Fonte:





